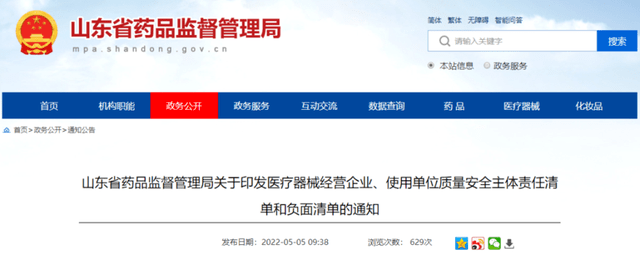
近日,山东省药监局制定印发医疗器械经营企业、使用单位质量安全主体责任清单和负面清单,明确医疗器械经营、使用主体在人员配备、采购管理、运输贮存、质量管理体系自查、不良事件监测等方面的主体责任和负面事项,并列明每条责任内容对应的法律法规依据。
新首宏认为,不只山东一省,全国各地对医疗器械行业的监管力度和措施都达到了史上最严!对医疗器械企业的监察抽检将成常态。
引领医械行业合规化,新首宏在行动!
近日,新首宏集团及各成员企业依据医疗器械经营企业、使用单位质量安全主体责任清单和负面清单,开展安全行为自查,坚决警惕违法“红线”,让集团全体员工更清楚的了解医疗器械经营及使用过程中,坚决不能触碰的行为。
5月25日,新首宏特邀青岛西海岸原市场局副局长张海军,通过对比解读《医疗器械经营管理办法》新、旧条款,结合企业经营、生产实际与日常监管等内容,系统地讲解了医疗器械法规及配套规章衔接的内容和法律责任,旨在树立全员合规理念,积极践行合规文化,真正形成卓有成效的自我约束机制,促进行业持续健康发展。

尽管当前医疗器械行业整体向好发展,但是在利益驱使下,行业内部依然充斥着众多业务能力不专、不深、不精,服务水平较低,内部管理混乱的中小代理、生产企业,这对于行业整体的信誉度、专业度及安全性的提升都是巨大阻碍。
新首宏集团作为行业最早探索合规化经营的企业,经过多年摸索,已经在集团内部成立了安全合规部,并外聘资深法律顾问做企业相应的合规辅导,从而让每一位新首宏的员工从心底牢固树立起合规意识,通过合规化管理来规避企业的法律风险,以此保证新首宏集团在安全合规的道路上走得更稳、走得更远。
近期发布,最严格的监管要求袭来!
5月1日开始,新版《医疗器械生产监督管理办法》《医疗器械经营监督管理办法》开始正式执行。两个办法落实“四个最严”要求,医疗器械企业负面清单也随之更新,将医疗器械行业生产和经营推向新的秩序。
由国家药监局、国家卫健委、国家医保局联合印发的《关于做好第二批实施医疗器械唯一标识工作的公告》指出,2022年6月1日起,生产的医疗器械应当具有医疗器械唯一标识。而对于未按照要求执行的企业,将被依法追究法律责任。
最强监管,全国开始严查!
今年4月起,山东省药监局探索实施“盲抽盲检”,加强“暗访暗查”,强化“联动联处”,严厉打击各类违法违规行为。

海南省药监局,在近日参加国家药监局医疗器械质量安全风险隐患排查整治工作汇报会中要求,要严厉打击、严肃查处各种违法违规行为,落实违法行为处罚到人要求,强化行刑衔接、行纪衔接,形成“利剑高悬”的震慑效果。
5月13日,河南省药监局召开严厉打击无证生产经营防疫用医疗器械工作视频会议,强调要充分利用投诉举报、监督抽检、风险信息、舆情监测、移送通报等多种手段,积极拓展案源线索,不断巩固整治成果。
参考这些地区的手段,相信其他省份必然也会及时跟进,医疗器械正式进入“强监管”时代!
企业合规化管理不是一朝一夕能够完成的,合规化不仅是建立一套成熟的管理制度,更需要行业全体成员的参与,共同构建合规文化体系。
新首宏集团始终秉承“安全就是生产力”的核心价值观,现已形成集医疗器械进出口服务、医疗器械检测服务、消毒产品与服务、医疗器械产业平台四大业务于一体的医疗器械产业生态圈。未来,新首宏集团将继续以“安全”为盾,以“合规”为尺,致力于医疗器械行业朝着安全、合规的方向健康发展,为医械行业全方位赋能。
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。